2016년 이후 끊긴 명맥 이어… 신약개발뿐 아니라 유통망 구축도 과제

▎유명희 산업통상자원부 통상교섭본부장 (가운데)이 3월 14일 충북 청주 녹십자 오창공장을 방문해 회사 관계자와 생산라인을 둘러보고 있다. / 사진:산업통상자원부 |
|
올 들어 미국 시판허가를 받았거나 기다리고 있는 국산 신약이 줄을 잇고 있어 바이오 업계 관심이 어느 때보다 뜨겁다. 지난해까지 미국에서 허가받은 국산 신약은 단 3종뿐이었지만 올 초에 벌써 2종이 허가를 받았고, 다른 5종이 허가 문턱에 다가선 상태다. 아직 글로벌 시장에선 황무지와 같은 한국 바이오의 위상이 새롭게 바뀌고 있는 모양새다. 지난해까지 미국 식품의약국(FDA)으로부터 허가받은 국산 신약은 LG화학의 항생제 ‘팩티브’(2003년)와 동아에스티의 수퍼항생제 ‘시벡스트로’(2014년), 그리고 SK케미칼이 개발한 혈우병신약 ‘앱스틸라’(2016년)까지 3종에 그쳤다. 그러나 올 들어 대웅제약과 SK바이오팜이 각각 신약을 허가받으면서 다시 포문을 열기 시작했다.
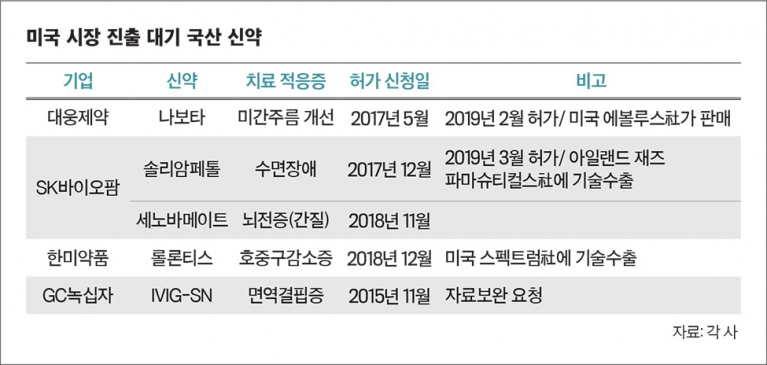
대웅제약·SK바이오팜, 미국 시장 진출 초읽기: 대웅제약은 지난 2월 미용 보툴리눔톡신제제 ‘나보타’에 대한 FDA 품목허가를 받았다. 나보타는 전 세계 최대 매출을 올리고 있는 미국 엘러간사의 ‘보톡스’와 경쟁모드에 돌입하게 된다. 나보타의 미국 상품명은 ‘주보’다. 대웅제약의 미국 유통·판매사인 에볼루스가 올 상반기 나보타를 미국 전역에 출시한다.SK바이오팜이 개발한 수면장애 신약물질 ‘수노시’(성분: 솔리암페톨)도 올 3월 21일 FDA 허가를 획득했다. 수노시는 기면증과 수면무호흡증으로 인한 낮 졸림증을 치료하는 신약으로 연구·개발에만 무려 23년이 걸렸다. 수노시는 앞으로 향정신성의약품분류 심사를 받게 된다. 수노시 판권을 갖고 있는 미국 재즈파마슈티컬스사는 분류심사가 끝나는 대로 올 7월쯤 미국 시장에 출시할 계획이다. 수노시는 앞서 임상1상을 마친 후 지난 2011년 미국 에어리얼 바이오파마사에 기술수출(라이센싱 아웃)됐다.이후 에이리얼 관련 사업부를 인수한 재즈파마슈티컬스사가 수노시의 미국 판권을 갖게 됐다. 수노시가 판매되면 SK바이오팜은 매출에 따른 일정비율의 로열티를 받게 된다. SK바이오팜은 뇌전증(간질) 신약물질 ‘세노바메이트’에 대해서도 지난해 11월 FDA 품목허가를 신청해 올해 말 허가 여부를 기다리고 있다. 세노바메이트가 허가를 받으면 물질 개발부터 글로벌 임상, 미국 품목허가 신청까지 국내 기업 한 곳이 직접 진행한 첫 사례가 된다.
한미약품·GC녹십자, 경쟁 의약품 적은 틈새시장 공략: 다음 FDA 허가주자로 떠오르는 기업은 한미약품과 GC녹십자 등이 있다. 이들 기업도 앞서 허가받은 곳처럼 치료제가 적지만 가치가 높은 시장을 정조준하고 있어 경쟁력을 갖췄다는 평가다.
지난 2015~2016년 기술수출 풍년을 이뤘던 한미약품이 하나둘 신약 수확에 나서고 있다. 한미약품의 미국 파트너사인 스펙트럼 파마슈티컬스는 지난해 12월 말 FDA에 한미약품이 개발한 호중구감소증 신약물질 ‘롤론티스’의 허가신청서를 냈다. 그러나 FDA가 최근 미국 생산 완제품에 대한 데이터 등 보완을 요청하면서 스펙트럼은 지난 3월 15일 허가신청을 자진 취하했다. 이는 규정상 품목허가 사전 심사기한인 3월 29일까지 보완자료를 내기 어렵다고 판단해서다. 스펙트럼은 이를 신속히 보완한 후 5~6월쯤 다시 허가신청을 하겠다는 계획이다. 이에 따라 롤론티스의 최종 FDA 품목허가 여부는 2020년 상반기에 판가름 날 전망이다. 롤론티스는 앞으로 FDA 허가를 받으면, 한미약품의 첫 미국 진출 신약이 된다. 한미약품은 스펙트럼에 지난 2012년 롤론티스를 기술수출했다.GC녹십자도 올해를 북미시장 진출의 원년으로 삼고 있다. GC녹십자는 지난 2015년 11월 혈액제제 ‘아이비글로불린-에스엔(IVIG-SN)’의 품목허가 신청서를 FDA에 제출했지만 지난해 9월 제조공정 관련한 자료 보완 요청을 받은 상태다. GC녹십자는 곧 자료를 보완해 제출하겠다는 계획이다. IVIG-SN은 선천성 면역결핍증과 혈소판 감소증 등 희귀질환에 쓰이는 약으로 이미 우리나라와 중남미, 중동 등에선 판매되고 있다.
바이로메드·에이치엘비·메지온, 임상3상 완료 허가신청 임박: 임상 3상을 완료하고 올해 그 결과를 발표할 국내 기업도 있다. 모두 해외 제약사에 기술수출 없이 직접 임상을 끌고 왔다는 점에서 높은 평가를 받고 있다. 국내 바이오기업 바이로메드는 미국서 진행한 당뇨병성 신경병증 신약물질 ‘VM202-DPN’의 임상 3상 결과를 올 6~8월 사이 발표할 계획이다. 지난해 7월 마지막 임상 피험자 투약을 마치고 9개월 간 추적 관찰하고 있다. VM202-DPN은 신경손상 때 통증 인자의 발현을 조절해 통증을 감소시키고 말초신경세포 재생을 촉진하는 유전자 신약물질이다.에이치엘비의 미국 자회사 LSK바이오파마(LSKB)도 지난해 10월 위암 신약물질 ‘리보세라닙’에 대한 글로벌 임상3상 환자등록을 모두 마치고 현재 데이터를 분석 중이다. 일정상 올 상반기 임상3상 결과를 발표한 후 하반기 미국 등 허가신청에 들어갈 것으로 예상된다. 리보세라닙은 1~2차 치료법으로도 효과를 보지 못한 위암 환자들에게 쓰이는 3차 치료제로 개발됐다.메지온은 심폐 관련 희귀질환 신약물질 ‘유데나필’에 대해 지난해 미국 임상3상을 완료하고 올 상반기 결과 발표를 앞두고 있다. 유데나필은 2016년 6월 임상3상을 시작하기 전 FDA로부터 희귀의약품으로 지정되면서 보통 1년 정도 걸리는 허가심사 기간을 6개월로 단축시켰다. 이에 따라 올해 안에 품목 허가가 이뤄질 가능성이 있다. 메지온의 유데나필은 구체적으로 선천성 심장기형인 심실이 하나만 존재하는 단심실 환자의 폰탄수술(우심방-폐동맥 우회술) 이후 합병증 예방을 목표로 한다. 폐혈관 저항은 줄이고 심실기능은 향상시키는 작용기전을 가지며 현재까지 경쟁 약은 없는 것으로 전해진다.메지온은 지난 2002년 동아제약 연구조직이 분사해 동아팜텍으로 설립됐다가 2013년 메지온으로 사명을 바꿨다. 앞서 동아제약 지주사인 동아쏘시오홀딩스가 최대주주였지만 현재는 양사 간 지분관계는 없다. 이승규 한국바이오협회 부회장은 “올해는 평소보다 임상3상을 마친 신약물질이 늘어나 좋은 성과가 나올 것”이라고 기대했다. 이 부회장은 이어 “이제는 신약개발뿐 아니라 미국 시장에서 수익 창출을 극대화하기 위한 탄탄한 유통망을 구축하는 것도 중요해진 단계”라면서 “이를 철저히 준비하면 앞으로는 신약개발부터 판매까지 우리가 아우르는 바이오생태계가 완성될 것으로 보인다”고 말했다.